ان الطيف الكهرومغناطيسي المنبعث من الذرة له من الأهمية في علم الفيزياء الذرية في التعرف على العناصر المختلفة حيث ان لكل عنصر من العناصر الموجودة في الطبيعة طيف كهرومغناطيسي خاص به ولا يوجد عنصرين لهما نفس الطيف. ولدراسة الطيف الكهرومغناطيسي نحتاج إلى تحليل الضوء المنبعث من اثارة ذرات العنصر اما بواسطة المنشور prism او بواسطة محزوزة الحيود diffraction grating كما في الشكل التالي:
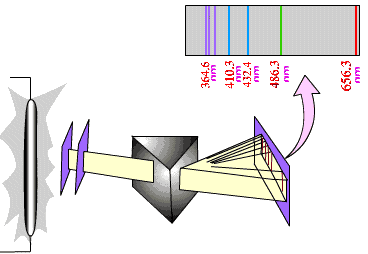
حيث يتم اثارة ذرات العنصر مثل الهيدروجين من خلال التفريغ الكهربي electric discharge حيث يوضع الغاز عند ضغط منخفض في انبوبة زجاجية مفرغة وبتطبيق فرق جهد كهربي على طرفي الأنبوبة الزجاجية، تحدث تصادمات بين الإلكترونات وذرات الغاز داخل الأنبوبة وتعمل على اثارة هذه الذرات إلى مستويات طاقة عالية ما تلبث إلى ان تعود الذرة إلى الحالة المستقرة وتنطلق طاقة على شكل فوتون يحمل فرق الطاقة بين مستوى الطاقة الأعلى إلى مستوى الطاقة الأقل يخرج على شكل طيف كهرومغناطيسي ليسقط على المنشور والذي يعمل على تحليله على اساس ان لكل طول موج زاوية انحراف معينة ويتم استقبال الضوء المتحلل على شاشة والعلم الذي يدرس الطيف الكهرومغناطيسي يسمى Spectroscopy والجهاز المستخدم لتحليل الضوء (الطيف الكهرومغناكيسي) يسمى Spectrograph.
الطيف الكهرومغناطيسي يكون اما طيف متصل continuous spectrumحيث يكون نتيجة تحليل الضوء الحصول على الوان الطيف التي تنتقل تدريجياً من لون إلى أخر بدون وجود انقطاع كما في الشكل التالي:

وإما ان يكون طيف خطي Line Spectrum يحتوي على مناطق لونية منفصلة تظهر على شكل خطوط كما في الشكل التالي:
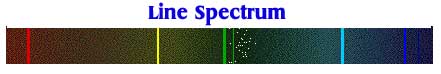
Each element, as mentioned above, has its own fingerprint spectrum. Each element has its own unique energy levels so that different colors are produced.
ان السبب في الطيف الخطي يعود إلى ألكترونات الموجودة في مستويات طاقة مختلفة للذرة حيث ان وجود الذرة في electric discharge يعمل على إذارة هذه الإلكترونات إلى مستويات طاقة عالية وعند عودة الإلكترونات إلى مستوى طاقة أدنى تنطلق طاقة في صورة طيف كهرومغناطيسي ذو طول موجي محدد من فرق الطاقة بين المستويين ولقد ركز العلماء على دراسة الطيف المنبعث من ذرة الهيدروجين لسبب أن ذرة الهيدروجين ابسط ذرة لاحتواءها على الكترون واحد وان اليهيدروجين المكون الرئيسي للكون.
في الاشكال التالية موضح عدة نماذج لامتصاص الكترون طاقة لينتقل إلى مستوى طاقة أعلى وبعدها تحدث انتقالات على عدة مراحل إلى مستوى طاقة منخفض.
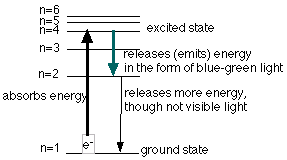
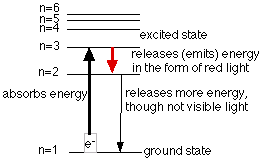
معلومات هامة
A continuum spectrum results when the gas pressures are higher. Generally, solids, liquids, or dense gases emit light at all wavelengths when heated.
An emission spectra are produced by thin gases in which the atoms do not experience many collisions (because of the low density). The emission lines correspond to photons of discrete energies that are emitted when excited atomic states in the gas make transitions back to lower-lying levels.
An absorption spectrum occurs when light passes through a cold, dilute gas and atoms in the gas absorb at characteristic frequencies; since the re-emitted light is unlikely to be emitted in the same direction as the absorbed photon, this gives rise to dark lines (absence of light) in the spectrum.
طيف ذرة الهيدروجين Hydrogen Spectra
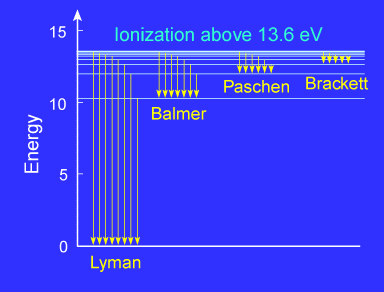
ركز العلماء على دراسة طيف ذرة الهيدروجين وتوالت الإكتشافات في هذا المجال حيث رصد العالم Balmer في العام 1885 الطيف المرئي لذرة الهيروجين وهي الأنتقالات التي يحدثها الإلكترون إلى المستوى n=2 كما في الشكل التالي:
وقد وضع العالم Balmer معادلة لحساب الاطوال الموجية لهذه المجموعة من طيف ذرة الهيدروجين وهي نتجت من تحليل النتائج العملية.
![]()
where n =3 , 4, 5, …. and l in unit of Angstrom.
هناك مجموعة لآخرى من طيف ذرة الهيدروجين اكتشفها العالم Lyman وهي في مدى الأشعة فوق البنفسجية واكتشف العالمان Paschen وBracket مجموعتين اخرتين في مدى الأشعة تحت الحمراء من الطيف الكهرومغناطيسي. ووضعت العديد من المعادلات التي تحسب هذه المجموعات من الأطوال الموجية وفي العام 1890 توصل العالم Rydberg إلى معادلة واحدة لحساب كل الأطوال الموجية لكل الأنتقالات المتوقعة من الذرة.
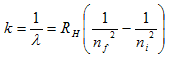
where RH is called Rydberg constant for hydrogen atom = 10967757m-1
ولمجموعة Balmer تكون المعادلة على الشكل التالي:
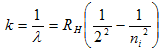
ni = 3,4,5,……
الجدول التالي يلخص المجموعات الطيفية لذرة الهيدروجين ومعادلة Rydberg لكل مجموعة.

هذه المعلومات الدقيقة عن طيف ذرة الهيدروجين مع نتائج نموذج رزرفورد فرضت على اي نموذج لذرة الهيدروجين يجب ان تؤخذ في الحسبان وهذا ما قام به العالم بوهر في فرضيته لنموذج ذرة الهيدروجين.



