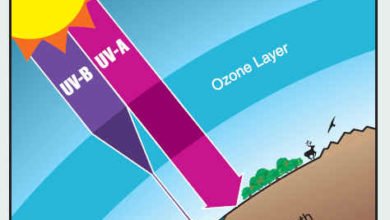
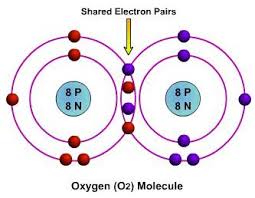
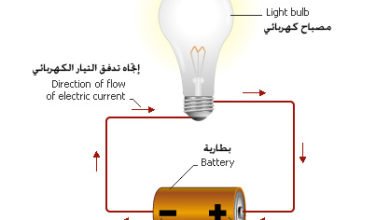
مصطلحات فيزيائية
الفيزياء الحديثة
 الفيزياء الحديثة من علوم الفيزياء الجديدة والتي ظهرت بعد اكتشاف النظرية النسبية ونظرية الكم، وتدرس الخاصية المزدوجة للشعاع الكهرومغناطيسي وللأجسام المادية.
الفيزياء الحديثة من علوم الفيزياء الجديدة والتي ظهرت بعد اكتشاف النظرية النسبية ونظرية الكم، وتدرس الخاصية المزدوجة للشعاع الكهرومغناطيسي وللأجسام المادية.
اعلانات جوجل
يشير مصطلح الفيزياءالحديثة إلى مابعد مفهوم نيوتن للفيزياء، أي ضغف
الوصف الكلاسيكي للظواهر الفيزيائية، وبالتالي فإن الوصف الدقيق للواقع يتطلب نظريات تدرج عناصر ميكانيكا الكم أو نسبية أينشتاين أو كلاهما.
ويستخدم عادة هذا المصطلح للإشارة إلى أي فرع من فروع الفيزياء طور في بداية القرن العشرين أو بعد ذلك أوتأثر بشكل كبير بفيزياء بداية القرن العشرين.