لماذا يتبخر الماء في درجة حرارة الغرفة؟
ندرك من ملاحظتنا اليومية انه عندما يغلي الماء، فإنه يتحول من سائل إلى بخار. ولإحداث هذا التغيير في حالة الماء، يتطلب الامر زيادة درجة الحرارة حتى نصل إلى نقطة الغليان. بالنسبة للماء، هذه النقطة هي 100 درجة مئوية. ومع ذلك أيضا، نلاحظ بعد هطول غزير للمطر تتكون برك مائية على سطح الأرض، ما تلبث وان تجف هذه البرك بعد شروق الشمس، وذلك بسبب تبخر الماء بواسطة اشعة الشمس. الا ان التبخر في اشعة الشمس لم يتم عند درجة حرارة الغليان بل عند درجات حرارة اقل بكثير من 100 درجة مئوية. لماذا يحدث هذا؟ في هذ المقال سوف نفسر سبب حدوث عملية التبخر للماء عند درجة حرارة الغرفة.
تكمن الإجابة في الخواص الفيزيائية والكيميائية لجزيئات الماء والروابط المتكونة بين تلك الجزيئات.
الخواص الكيميائية لجزيئات الماء
يتكون جزيء الماء من ذرتين هيدروجين متصلتين بذرة أكسجين واحدة. تتشكل الروابط بين ذرات O وH من خلال مشاركة الإلكترونات. تسمى هذه الروابط بالروابط التساهمية covalent bonds. يميل كل عنصر إلى الوصول إلى الحالة الأكثر استقرارًا عن طريق فقدان أو اكتساب الإلكترونات للوصول إلى أقرب تكوين للغازات النبيلة.
يحتوي الأكسجين على ست إلكترونات في الغلاف الخارجي له ويتطلب إلكترونين لإكمال الثمانية. بينما يحتوي الهيدروجين على إلكترون واحد في غلافه الخارجي، ومن خلال اكتساب إلكترون واحد. وهكذا، تشترك ذرة أكسجين واحدة مع إلكترونين من ذرتي هيدروجين وتتشارك ذرتان من الهيدروجين بإلكترون واحد لكل منهما لتشكيل جزيء واحد من الماء، أي H2O.
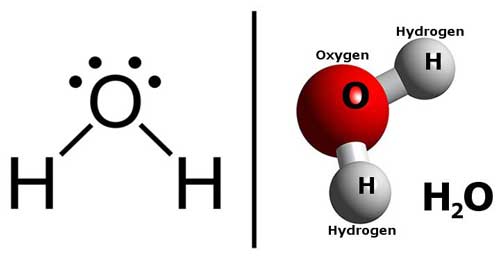
جزيء الماء له شكل منحني قليلاً بسبب الإلكترونات الموجودة في ذرة الأكسجين. هذا يساهم في الترابط الهيدروجيني بين الجزيئات.
يميل الأكسجين بشدة إلى جذب الإلكترونات نحوه. هذه الخاصية تسمى السالبية الكهربائية أو الكهرسلبية electronegativity. وهي عبارة عن مقياس لمقدرة الذرة في الجزيء التساهمي على جذب الإلكترونات في الروابط الكيميائية؟ بسبب الطاقة الكهربية العالية للأكسجين، فان الإلكترونات تقضي وقتًا أطول بالقرب من ذرة الاكسجين وتتطور شحنة سالبة جزئية عليها. وبالمثل، تتطور شحنة موجبة جزئية على H. مثل هذه الهندسة الجزيئية للماء تسمح بوجود فاصل موجب (بالقرب من ذرتي الهيدروجين) وشحنات سالبة عند ذرة الأكسجين.
عندما يقترب جزيئي ماء من بعضهما البعض، يميل الاكسجين السالب جزئيًا إلى جذب ذرة هيدروجين موجبة جزئيًا من جزئي الماء الاخر، مما يؤدي إلى رابطة ضعيفة تسمى رابطة الهيدروجين Hydrogen Bond. توجد هذه الرابطة بين جزيئين مختلفين من الماء. نظرًا لأن الرابطة الهيدروجينية ضعيفة، فإن كسرها يتطلب طاقة أقل، وهذا هو سبب بقاء الماء سائلاً في درجة حرارة الغرفة.
درجة الحرارة والطاقة الجزيئية
درجة الحرارة هي مقياس لمتوسط الطاقة الحركية التي يمتلكها الجزيء. كلما ارتفعت درجة الحرارة، زاد متوسط الطاقة، وأصبح من الأسهل للجزيئات التغلب على التجاذب بين الجزيئات والتحرك بحرية أكبر. لكي يتغير السائل بخار، يجب التغلب على قوتين.
تؤدي زيادة درجة الحرارة إلى زيادة طاقة الجزيئات عند الضغط ثابت، مما يجعلها أقرب إلى حالة البخار.
القوى الأولى هي التجاذب بين الجزيئات القريبة من بعضها البعض، والتي تسمى قوى التماسك cohesive forces. والقوى الثانية هي قوى الضغط الذي يمارسه الضغط الجوي على الماء. عندما يغير السائل حالته من الحالة السائلة إلى الحالة الغازية، فإن جزيئاته تكون قد اكتسبت طاقة حركية كافية للتغلب على جميع القوى بين الجزيئات، وأيضًا للتغلب على الضغط الذي يمارسه الغلاف الجوي من حوله.
الرطوبة
كمية بخار الماء الموجودة في الغلاف الجوي تسمى الرطوبة. في أي درجة حرارة معينة، يمكن للغلاف الجوي أن يحتفظ فقط بكمية ثابتة من بخار الماء. كلما زادت درجة الحرارة، زادت كمية بخار الماء الموجود في الغلاف الجوي. تركيز بخار الماء في الغلاف الجوي له حد أعلى، لا يمكن بعده احتجاز بخار الماء.
التبخر في درجة حرارة الغرفة
افترض أن الماء منتشر بشكل ضئيل على طاولة الطعام مثلا. تخيل ان كمية الماء هذه مكونة من طبقات من جزئيات الماء. تتعرض الجزيئات الموجودة في الطبقة العليا لقوى جذابة بين الجزيئات فقط من الأسفل والجوانب، في حين أن الجزيئات الموجودة داخل الكتلة السائلة تتعرض للتجاذب بين الجزيئات من جميع الاتجاهات. وبالتالي، فإن الجزيئات الموجودة في الجزء العلوي تعاني من صافي قوى بين الجزيئات أقل من تلك الموجودة داخل الكتلة. نظرًا لضعف هذه القوى بين الجزيئات (روابط الهيدروجين)، عندما تتعرض الطبقة العليا لأشعة الشمس، تكتسب بعض الجزيئات طاقة حركية كافية للهروب إلى الغلاف الجوي عند درجة حرارة الغرفة.
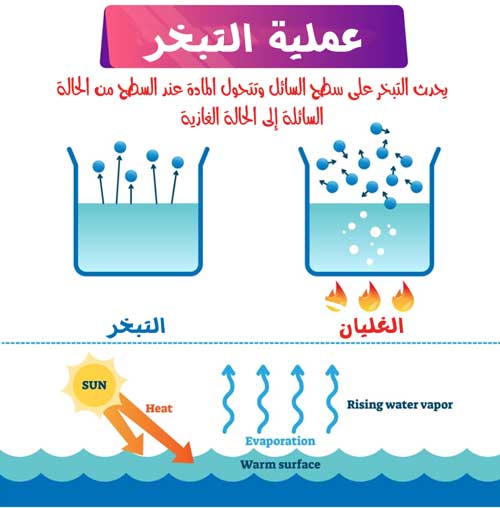
في التبخر، على عكس الغليان، تمتلك بعض الجزيئات الموجودة على السطح طاقة كافية لدخول مرحلة البخار.
علاوة على ذلك، كلما انخفضت الرطوبة، كان من الأسهل تبخر السائل. مع استمرار التبخر، يزداد تركيز بخار الماء في الغلاف الجوي. بعد عتبة حرجة، لا مزيد من بخار الماء يمكن أن يحتفظ به الغلاف الجوي. وهذا ما يسمى بالحالة المشبعة. إذا لم يتم الوصول إلى حالة التشبع، تستمر عملية التبخر.
وهكذا، فإن الجمع بين الرطوبة والطاقة الجزيئية يجعل من الممكن لبعض الجزيئات الموجودة على السطح أن تتبخر، حتى في درجات الحرارة المنخفضة!







اليس للضغط الجوي عامل في درجة التبخر حيث يتناسب عكسيا ؟؟
بالنسبة للون الأحمر طوله الموجي اكبر من الألوان الأخرى لذا يستخدم في حالات الإنذار والطوارئ واشارات المرور
السؤال : لماذا مصابيح الضباب في السيارات لا تكون باللون الأحمر وانما تكون باللون الأصفر فلماذا لم يستخدم اللون الأحمر حتى يمر من الضباب لأبعد مسافة ممكنة ؟