الخصائص الموجية للجسيمات المادية وفرضية ديبرولي De Broglie Postulate: علمنا مما سبق أن للأشعة الكهرومغناطيسية خاصية موجية وخاصية جسيمية وان العديد من الظواهر الفيزيائية للأشعة الكهرومغناطيسية لا يمكن تفسيرها إلا إذا اعتمدنا على الخاصية الجسيمية مثل ظاهرة الانعكاس والانكسار والظاهرة الكهروضوئية، كما ان هناك ظواهر فيزيائية مثل التداخل والحيود لا يمكن تفسيرها إلا بالاعتماد على الخاصية الموجية للضوء.
بتطبيق نظرية الكم على الشعاع الكهرومغناطيسي يمكن اعتبار الضوء مكون من فوتونات لها طاقة E وكمية حركة p.
Energy of the photon E = h f
Momentum of the photon p = h/λ
تظهر الخصائص الموجيه في هاتين المعادلتين في الطرف الأيمن في λ و f بينما تظهر الخواص الجسيمية في الطرف الأيسر من المعادلتين في E و p.
والسؤال الذي يطرح نفسه الآن هل يمكن للجسيمات المادية كالإلكترون؟ أي هل الخاصية المزدوجة موجودة في الجسيمات؟
وللإجابة على هذا التساؤل سنتناول دراسة الجزء الثاني من الفيزياء الحديثة…..
حيث أننا وجدنا أن للأشعة الكهرومغناطيسية خاصية موجية وخاصية جسيمية لذا يكون للأشعة الكهرومغناطيسية خاصية مزدوجة وعند تفسير الظواهر الضوئية نعتمد على أحدى هاتين الخاصيتين، فهل للجسيمات المادية خاصية مزدوجة أي يمكن التعامل مثلاً مع الإلكترون على انه موجة هذا ما افترضه العالم ديبرولي De Broglie من خلال المعادلة
p = h/λ = h/mv De Broglie relation
ومن هذا المعادلة يكون لكل جسم كتلته m موجة طولها λ وحتى تكون قيمة الطول الموجي مقاسة عمليا فإننا لا يمكن إلا التعامل مع الجسيمات الذرية مثل كتلة الإلكترون.
لا بد أن يتساءل المرء عن طبيعة موجة الإلكترون هذه وهنا يقول العالم ديبرولي انه ليس مهما ان نعرف طبيعة موجة الإلكترون ويكفي أن نثبت أن الإلكترون يحيد ويتداخل وهي من الظواهر الفيزيائية للموجات. كما إن الضوء عرف أن له سلوك موجي قبل معرفة إن موجة الضوء هي تغير في المجال الكهربي والمغناطيسي ينتشر في الفراغ بسرعة 300000 كيلومتر في الثانية ولهذا سميت بالأشعة الكهرومغناطيسية عند التعامل مع الخاصية الموجية للضوء وسميت بالفوتون عند التعامل مع الخاصية الجسيمية له.
لماذا تأخر اكتشاف الخاصية الموجية للجسيمات المادية؟
اكتشفت الخاصية الموجية للإلكترونات في عام 1927 من خلال التجربة التي أجراها العالمان دافيسون وجيرمر Davison and Germer حيث تم في هذه التجربة إثبات حيود الإلكترونات وتم حساب الطول الموجي للإلكترونات ليتوافق مع فرضية ديبرولي. ولتفسير سبب تأخر اكتشاف الخاصية الموجية للإلكترون بعد اكتشاف الخاصية الجسيمية له، فإن ذلك يعود إلى صغر الطول الموجي للجسيمات، فإذا قمنا باستخدام فرضية ديبرولي لحساب الطول الموجي للجسم كتلته 1 كيلوجرام يتحرك بسرعة مقدارها 1م/ثانية لوجدنا أن الطول الموجي المصاحب لهذا الجسم هو على النحو التالي:
p = h/λ = h/mv = 6.6×10-24Å
ولهذا فإن لكي نستطيع ملاحظة الخاصية الموجية للجسيمات المادية فإن كلا من كتلة الجسم وسرعته يجب أن تكون صغيرة وهذا يعني أن الخاصية الموجية للجسيمات المادية لا يمكن ملاحظتها إلا في الجسيمات الذرية مثل الإلكترون والبروتون والنيوترون.
يمكننا حساب طاقة حركة الإلكترون الذي يجب ان يمتلكها ليكون له طول موجي يساوي 1 انجستروم من خلال المعادلة التالية:
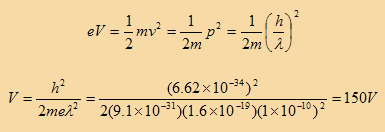
ومن هذه المعادلة نستنتج أن الإلكترون الذي يتحرك بطاقة 150 إلكترون فولت تكون طول الموجة المصاحبة له 1 انجستروم. وهذا هو الطول الموجي لأشعة اكس. لذا فإن من المتوقع أن تكون النتائج العملية لتجربة حيود أشعة اكس مماثلة لحيود الكترونات معجلة في فرق جهد قدره 150 فولت.
كيف يمكن إثبات أن حيود الإلكترونات مشابه لحيود أشعة اكس؟
تستخدم محزوزة الحيود Diffraction Grating في تجربة حيود الأشعة الكهرومغناطيسية في منطقة الطيف المرئي حيث الطول الموجي يتراوح بين 3000 إلى 7000 انجستروم. أم في حالة الأطوال الموجية الصغيرة جدا (منطقة اشعة اكس) فإن سمك الحزوز يعتبر كبيرا جداً لملاحظة حيود اشعة اكس، ولهذا السبب يتم استخدام البلورات Crystal معتمدين على الترتيب الدقيق لذرات الخلية المكونة للبلورة مما تتكون مستويات حيود ذات مسافات فاصلة في حدود 3-1 انجستروم.
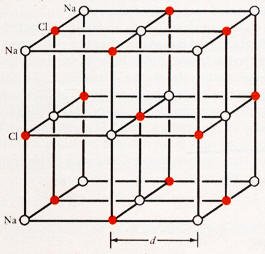
قياس المسافة الفاصلة d في بلورة NaCl
تعتبر بلورة كلوريد الصوديوم ذات تركيب بلوري خاص وبسيط ويمكن استخدامها لقياس حيود اشعة اكس. يتكون الشكل الخارجي لبلورة كلوريد الصوديوم كما في الشكل المقابل حيث تترتب ذرات الصوديوم والكلور في شكل متعاقب ومتماثل وتكون المسافة الفاصلة بين ذرتين متجاورتين d. ولحساب المسافة الفاصلة عن طريق الكثافة والوزن الجزيئي للصوديوم والكلور وععد افوجادرو يتم ذلك على النحو التالي:
إذا كانت d مقاسة بالسنتمتر من ذرة الصوديوم إلى أقرب ذرة كلور يكون هناك 1/d ذرة على طول 1 سنتمتر مكعب, ولهذا في مكعب الصوديوم والكلور يكون العدد الكلي للذرات لكل وحدة حجوم 1/d3 ذرة، حيث أن الوزن الجزيئي للصوديوم 23 والكلور 35.45 ولذلك يكون الوزن الجزيئي لكلوريد الصوديوم 58.45 لأن عدد أفوجادرو يعطي عدد الذرات في الجرام مول، وهذا يعني أن يكون عدد الذرات في 23 جرام صوديوم يساوي عدد افوجادرو ذرة وكذلك يوجد عدد افوجادرو ذرة في الـ 35.49 جرام كلور، ولهذا فإن عدد الذرات في في كلوريد الصوديوم 58.45 جرام يساوي ضعف عدد افوجادرو. ومن كثافة الصوديوم 2.163 جرام لكل سنتمتر مكعب فإن:
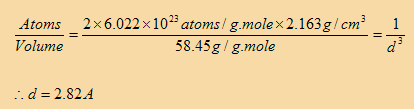
وهذا يكون المسافة الفاصلة بين اقرب ذرتين في بلورة كلوريد الصوديوم..


