علمنا في الميكانيكا أن الشغل المبذول على جسم مادي يساوي التغير في الطاقة الحركية للجسم. كما يمكن أن يكون هناك شغل لا يصحبه تغير في الطاقة الحركية أو طاقة الوضع مثل الشغل المبذول على غاز في عملية ضغط عليه أو كما في حالة الشغل المبذول بواسطة بطارية كهربية لشحن مكثف كهربي. يدرس علم الديناميكا الحرارية هذه الظواهر وفي هذه المحاضرة سنركز على الشغل المبذول على غاز.
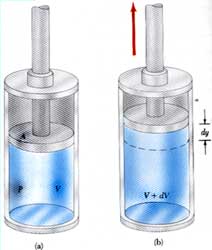 لنفترض نظام كما في الشكل له حجم V، يؤثر النظام بضغط منتظم على المكبس مما يجعله يتحرك مسافة dy ويزداد الحجم بمقدار dv أي أن النظام يتمدد Expand.
لنفترض نظام كما في الشكل له حجم V، يؤثر النظام بضغط منتظم على المكبس مما يجعله يتحرك مسافة dy ويزداد الحجم بمقدار dv أي أن النظام يتمدد Expand.
القوة المؤثرة على عنصر المساحة dA (المكبس) هي dF
dF = P dA
حيث أن المساحة dA تحركت مسافة dy فإن الشغل المبذول بواسطة القوة dF هو
dF dy = P dA ds
dW = P dV
هذه المعادلة التي تحسب الشغل في حالة تغير الحجم وبالتعويض عن وحدة الضغط ووحدة الحجم نجد أنها وحدة طاقة وهي الجول.
ملاحظات:
عندما يتمدد الغاز (Expand) فإن التغير في الحجم dV يكون موجباً ويكون الشغل المبذول موجب ونقول أن الغاز يبذل شغل على المحيط Work done by the gas.
عندما ينضغط الغاز (Compressed) فإن التغير في الحجم dV يكون سالباً ويكون الشغل سالب ونقول أن شغل بذل على الغاز Work done on the gas.
في عملية تحت حجم ثابت (Isochoric) أي أن dV=0 فإن الشغل يساوي صفر.
في عملية تحت ضغط ثابت (Isobaric) فإن الشغل يساوي الضغط في الحجم النهائي ناقص الحجم الإبتدائي
W = P (V2 – V1)
في عملية تحت درجة حرارة ثابتة (Isothermal) فإننا سنعوض عن الضغط بالمعادلة العامة للغاز المثالي.
PV = nRT & P = nRT/V
ويكون الشغل في هذه الحالة

منحنى الضغط والحجم PV diagram
في الحالة العامة يكون الضغط غير منتظم ويعتمد على كلاً من الحجم ودرجة الحرارة، فإذا علمنا كلاً من الضغط والحجم على جميع مراحل العملية فإن حالة الغاز عند كل مرحلة يعبر عنها بمنحنى التغير بين الضغط ودرجة الحرارة. ويعرف هذا المنحنى باسم PV diagram.
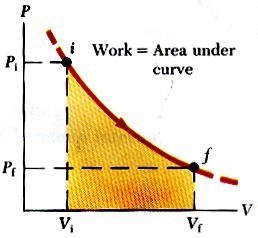 في الشكل المقابل نوضح منحنى الضغط والحجم لعملية على غاز مثالي تغيرت فيه حالته من الوضع الابتدائي i إلى الوضع النهائي f على المسار المنحني المبين في الشكل. حيث يوضح علاقة الضغط والحجم عند كل مرحلة من مراحل العملية وبإجراء التكامل على عنصر الحجم dV نحصل على الشغل الكلي المبذول خلال العملية وهذا التكامل هو أيضا المساحة تحت المنحنى.
في الشكل المقابل نوضح منحنى الضغط والحجم لعملية على غاز مثالي تغيرت فيه حالته من الوضع الابتدائي i إلى الوضع النهائي f على المسار المنحني المبين في الشكل. حيث يوضح علاقة الضغط والحجم عند كل مرحلة من مراحل العملية وبإجراء التكامل على عنصر الحجم dV نحصل على الشغل الكلي المبذول خلال العملية وهذا التكامل هو أيضا المساحة تحت المنحنى.
أي أن المساحة تحت منحنى PV diagram يعبر عن الشغل الكلي.
في الأشكال التالية نوضح عملية تمت بين الوضع الابتدائي i إلى الوضع النهائي f على مسارات مختلفة لنوضح أن الشغل هنا يعتمد على المسار.
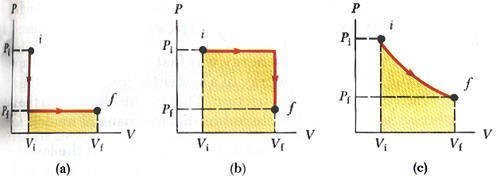
In the first case (a) the gas pressure reduce at constant volume and then expand to Vf at constant pressure, the total work done is
W = 0 + Pf (Vf – Vi)
In case (b) the the gas expand at constant pressure Pf and then at constant volume Vf the pressure reduced to P1 at constant volume Vf, the work done on the gas is
W = Pi (Vf – Vi) + 0
In case (c) the pressure and the volume change from the initial to the final at the curved path i.e. both the pressure and the volume are varies during the process, the total work is
We can conclude from the three cases that the work done depends on the path between the initial and the final state.
Spatial Case
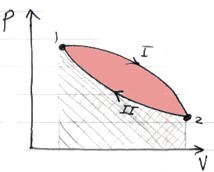 If two processes were done on a system as shown in the figure what is the work done?
If two processes were done on a system as shown in the figure what is the work done?
The positive work along the path I is greater than the negative work along the path II. The net work in the cycle is then positive and the net work is represented by the area bounded by the closed path.

W = P2 (V2 – V1) + P1 (V1 – V2)
يلاحظ أنه لإيجاد الشغل الكلي يمكن أن يتم من خلال إيجاد المساحة أو من خلال إيجاد الشغل في كل عملية ثم جمعها لإيجاد الشغل الكلي.



