توصف حالة كتلة m من مادة معينة من خلال الاحداثيات الثيرموديناميكية وهي الضغط والحجم ودرجة الحرارة. وبصفة عامة هذه الكميات (P,V,T) لا يمكن ان تتغير بطريقة مستقلة عن بعضها البعض حيث ان هناك دائما علاقة تربط بين الضغط والحجم ودرجة الحرارة لتحديد حالة المادة ورياضيا نقول ان هناك معادلة تسمى معادلة الحالة لتحدد العلاقة بين تلك الكميات الفيزيائية تأخذ الصورة التالية:
V = f (p,T,m)
وهذا يعني ان حجم كتلة محددة من المادة تعتمد على الضغط p ودرجة الحرارة T والكتلة mوالمعادلة التي تربطهم معا تسمى معادلة الحالة Equation of State.
ملاحظة: من الصعب ايجاد معادلة حالة لتحديد العلاقة بين الضغط والحجم ودرجة الحرارة للمادة بدقة لذا سنقوم اولا بدراسة معادلة الحالة للغاز المثالي ثم التعديل الذي اضافه العالم فاندرفال على معادلة الحالة ثم سندرس اسطح الـ PVT
معادلة الحالة للغاز المثالي Ideal Gas Equation
الغاز المثالي هو الغاز الذي تنطبق عليه الشروط التالية:
(1) حجم جززيئات الغاز مهمل بالنسبة للوعاء الذي يحتويه.
(2) القوة المتبادلة بين الجزيئات مهملة ايضا والتصادمات بين جزيئات الغاز تصادمات مرنة.
(3) حركة الجزيئات حركة عشوائية.
تتحقق هذه الشروط للغاز الموجود عند درجات الحرارة العادية والضغط المنخفض، لذا يمكن اعتبار الغاز الموجود في الغرفة غازاً مثالياً. الغاز المثالي يخضع للمعادلة التالية:
PV = nRT Ideal Gas Equation
حيث n عدد المولات وR الثابت العام للغازات.
هذه المعادلة تسمى معادلة الحالة للغاز المثالي وتم اهمال حجم جزيئات الغاز والقوة المتبادلة بين الجزيئات.
اذا افترضنا ان غاز مثالي موجود في مكبس يمكن زيادة الضغط على الغاز مع الحفاظ على درجة الرارة ثابتة فإن الحجم سوف يتغير مع الضغط كما في الشكل التالي وطبقا لمعادلة الحالة للغاز المثالي.
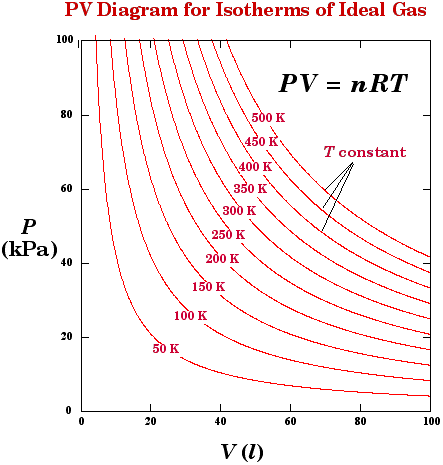
كل منحنى من المنحنيات السابقة يمثل درجة حرارة مختلفة وهنا العلاقة بين الضغط والحجم تخضع لمعادلة الحالة للغاز المثالي لذا نقول ان الغاز الذي يتصرف بهذا الشكل هو غاز مثالي.
معادلة الحالة للغاز الحقيقي VanderWaal Equation
عندما يحيد الغاز عن العلاقة السابقة وتصبح منحنيات الحجم والضغط تشذ عن الشكل السابق لا يمكن ان نطبق المعادلة السابقة PV=nRT، نلاحظ في الشكل التالي انه عند درجات حرارة منخفضة اصبح شكل المنحني يختلف عن كونه منحنى قطع ناقص وذلك لان الغاز عند درجات الحرارة المنخفض لا يمكن اعتباره غازاً مثالياً ولذلك قام العالم فان ديرفال بصياغة معادلة جديدة يمكن استخدامها للغاز الحقيقي وهي
(P-a/v2) (V-b)=nRT VanderWaal Equation
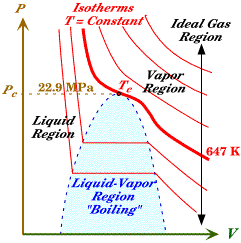
حيث تم الاخذ في الحسبان حجم جزيئات الغاز وطرحه من حجم الوعاء الذي يحتوي الغاز من خلال المعامل b وكذلك احتساب القوة المتبادلة بين الجزيئات من خلال اضافة المعامل a/v2 إلى الضغط.
مع العلم بأن كلا من a و b هي ثوابت عددية يتم تحديدهما ليحققان انسب قيمة للنتائج المعملية.
اسطح الضغط والحجم ودرجة الحرارة
دعت الحاجة الى استخدام التمثيل البياني لمعادلة الحالة للمادة لعدم وجود معادلة دقيقة تربط بين الضغط ودرجة الحرارة والحجم لمختلف المواد ولمدى واسع من التغير في قيم الاحداثيات الثيرموديناميكية، لذا اذا ما تم تمثيل المتغيرات الثلاثة P,V,T فإن هذا سوف يشكل اسطح ولتوضيح ذلك سوف نستعين بالشكل المبين ادناه
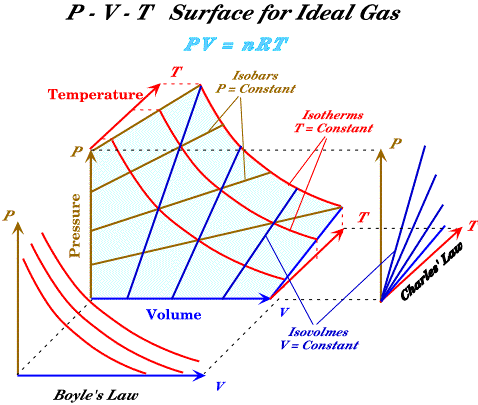
يمثل الشكل السابق العلاقة بين الحجم (الاحداثي باللون الازرق) والضغط (الاحداثي باللون البني) ودرجة الحرارة (الاحداثي باللون الأحمر) لغاز يتصرف كغاز مثالي، ومسقط الاحداثيات المبين اسفل الشكل يمثل العلاقة بين الضغط والحجم (قانون بويل) ومسقط الاحداثيات على يمين الشكل يمثل العلاقة بين الضغط ودرجة الحرارة (قانون تشارلز).
اسطح PVT للغاز الحقيقي
عند زيادة الضغط وانخفاض درجات الحرارة يسلك الغاز سلوك مختلف عن الغاز المثالي حيث تتحول المادة من الحالة الغازية إلى السائلة أو الصلبة. ولكن لا تزال هناك علاقة بين الضغط والجم ودرجة الحرارة للمادة مهما اختلفت حالتها وهذا يعني ان للمادة معادلة حالة ولكن هنا يصبح الامر في غاية التعقيد في ايجاد معادلة رياضية لذا يتم الاستعانة باسطح PVT لتمثيل ذلك بالرسم.
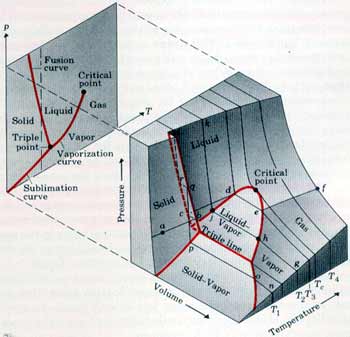
في الشكل الموضح ادناه يبين اسطح PVT لمادة في حالاتها الثلاثة الغازية والسائلة والصلبة. في حين توضح المنحنيات باللون الأحمر الفواصل بين هذه الحالات.
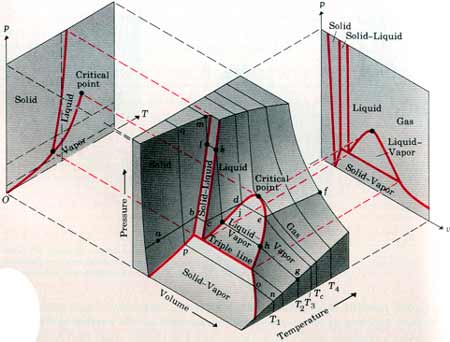
لفهم هذه المنحنيات دعنا نفترض عينة من مادة في الحالة الصلبة موضوعة في مكبس وبزيادة درجة الحرارة عند ثبوت الضغط وهذا ممثل على الشكل اعلاه في المسار abcdef حيث في البداية عند النقطة a تزداد درجة حرارة العينة نتيجة للتسخين المستمر فيزداد الحجم حتى نصل الى النقطة b التي تبدأ عندها العينة بالذوبان لتتحول من الحالة الصلبة إلى الحالة السائلة فيزداد الحجم وتثبد درجة الحرارة حتى تتحول العينة الى الحالة السائلة (النقطة c) يستمر الحجم في الزيادة وترتفع درجة الحرارة حتى نصل الى النقطة d فتتحول العينة الى الحالة الغازية وعندها يزداد الحجم بشكل اكبر وتثبت درجة الحرارة على المسار من d إلى eفتتحول العينة الى غاز وبزيادة التسخين ترتفع درجة الحرارة ويزداد الحجم.
أما على المسار ghjklm فيمثل عملية ضغط الغاز عند ثبوت درجة الحرارة وهنا بزيادة الضغط يتحول الغاز الى الحالة السائلة ثم إلى الحالة الصلبة مروراً بنقاط التقاطع على المنحنيات باللون الأحمر الثي يحدث عندها التحول من حالة إلى أخرى مع ثبوت الضغط وعلى طول المسار يقل الحجم، وكما هو موضح في الشكل ان الحجم يقل بصورة كبيرة بزيادة الضغط عندما تكون العينة في الحالة الغازية ويقل هذا النقصان في الحجم في الحالة السائلة والحالة الصلبة.
ملاحظة: من خلال هذه الرسومات يمكن تحديد حالة المادة عند اية ظروف من الضغط ودرجة الحرارة والمنحنيات باللون الأحمر تحدد مرحة التحول من حالة إلى أخرى وخلال هذه المنحنيات تكون المادة متواجدة في حالتين معا اما عند الخط الذي يمثل Triple line فإن الماتة تتواجد في حالاتها الثلاثة في آن واحد.
ملاحظة: يمكن تمثيل اية عملية على هذه المنحنيات من خلال تتبع المسار على الشكل السابق مع ملاحظة ان العمليات التي تتم عند ثبوت الضغط فإن المسار يكون متغير على الاحداثيين الحجم ودرجة الحرارة أما اذا كانت العملية عند ثبوت درجة الحرارة فإن التغير في المسار على الاحداثيين الضغط والحجم.
مخطط الطور Phase Diagram
من الملاحظ ان الاسطح PVT صعبة التحليل والقراءة لانها تمثل ثلاثة ابعاد ولكن لجعل الامر اكثر يسراً واوضح يمكن التعامل مع مسقط هذه الاسطح على احداثي الضغط ودرجة الحرارة، فنحصل على الشكل التالي الذي يعرف بالـ Phase Diagram
او بشكل اوضح كما يلي:
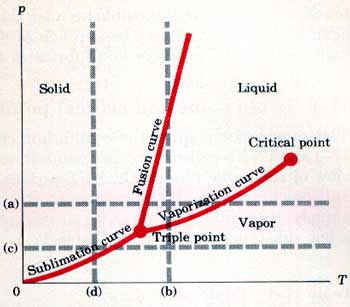
نلاحظ أن على هذا المخطط كل نقطة تمثل حالة واحدة للمادة اما النقط على المنحنيات باللون الأحمر فتمثل تواجد حالتين معاً للمادة. وهذه المنحنيات تسمى منحنيات التوازن Equilibrium Curves والتي تحدد قيم الضغط ودرجة الحرارة التي يمكن ان تتواجد عندها المادة في الحالة الصلبة أو الحالة السائلة أو الحالة الغازية.
ومنحنيات التوازن هي منحنى التبخر Vaporization Curve يفصل بين الحالة الغازية والسائلة ومنحنى الانصهار Fusion Curve يفصل بين الحالة السائلة والصلبة ومنحنى التسامي Sublimation Curve يفصل بين الحالة الغازية والصلبة.
تمثل الخطوط المنقطة a و c عمليات عند ثبوت الضغط بينما الخطوط d و b تمثل عمليات عند ثبوت درجة الحرارة والتقاطع بين الخطوط المنقطة والمنحنيات باللون الأحمر تحدد نقطة الانصهار ونقطة الغليان.
النقطة الثلاثية والنقطة الحرجة Triple Point and Critical Point
كما هو موضح في الشكل السابق نقطة تقاطع منحنيات التوازن الثلاثة تعطي النقطة الثلاثية Triple Point والتي تتواجد عندها المادة في حالاتها الثلاث في نفس الوقت ولكل مادة نقطة ثلاثية وحيدة.
الجدول التالي يوضح درجة الحرارة والضغط للنقطة الثلاثية لعدد من المواد.
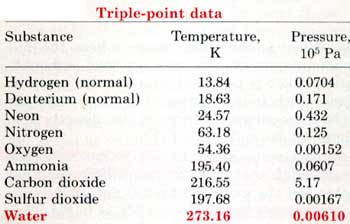
أما النقطة الحرجة Critical Point فهي التي تكون في نهاية منحنى التبخر والتي بعدها لايمكن تحويل البخار إلى سائل وتسمى درجة الحرارة والضغط عندها بدرجة الحرارة الحرجة والضغط الحرج.
تعريفات هامة:
البخار Vapor وهو الغاز عند درجة حرارة اقل من الدرجة الحرجة.
ضغط البخار Vapor Pressure هو ضغط البخار المتواجد في حالة اتزان مع السائل أو الصلب عند اية درجة حرارة.
نقطة الغليان Boiling Point هي درجة الحرارة التي يكون عندها ضغط البخار يساوي الضغط الجوي.
البخار المشبع Saturated Vapor هو البخار المتاجد في حالة اتزان حراري عند درجة حرارة وضغط ما مع السائل.

